Xung quanh việc trùng tên thuốc điều trị Covid-19: Công bố tên thương mại của thuốc khi đang nghiên cứu?
Đây là câu hỏi nhiều nhà chuyên môn đặt ra đối với thuốc thử nghiệm Vipdervir do Viện Hàn lâm Khoa học và Công nghệ Việt Nam công bố.
Chiều 12/8, Viện Hàn lâm Khoa học và Công nghệ Việt Nam đã có thông báo về việc sản phẩm thuốc thử nghiệm Vipdervir và thực phẩm bảo vệ sức khỏe Vipdervir C do Công ty Cổ phần Dược phẩm Vinh Gia sản xuất và quảng cáo đang gây xôn xao dư luận những ngày qua.
Thông báo nêu rõ ngày 12/8, Viện Công nghệ Sinh học (trực thuộc Viện Hàn lâm Khoa học và Công nghệ Việt Nam) đã ban hành công văn số 421/CHSH khẳng định công ty đơn phương sản xuất, đăng ký lưu hành thực phẩm bảo vệ sức khỏe Vipdervir C là không đúng với nội dung hợp đồng Hợp tác công nghệ sản xuất (chế phẩm Vipdervir) ký ngày 20/8/2020 giữa Viện Công nghệ Sinh học và Công ty Cổ phần Dược phẩm Vinh Gia.
Viện Công nghệ sinh học yêu cầu công ty thay đổi tên thực phẩm bảo vệ sức khỏe Vipdervir-C để tránh hiểu nhầm cho người tiêu dùng.

trên người bệnh Covid-19.
Thực phẩm chức năng "trùng" với tên thuốc điều trị Covid-19
Ngày 10/8, Viện Hàn lâm Khoa học và Công nghệ Việt Nam đã phối hợp với Bộ Y tế tổ chức buổi Họp báo trực tuyến công bố kết quả nghiên cứu thành công giai đoạn tiền lâm sàng thuốc thử nghiệm điều trị Covid-19 có tên là Vipdervir.Đây là kết quả nghiên cứu của Viện Công nghệ Sinh học do PGS.TS Lê Quang Huấn chủ trì, có sự đánh giá khoa học của cơ quan chuyên môn có thẩm quyền trực thuộc Bộ Y tế.
Tuy nhiên, ngay sau đó, trên mạng xã hội chia sẻ một sản phẩm thực phẩm chức năng có thiết kế nhãn hiệu tương tự với tên gọi Vipdervir C của Công ty Cổ phần Dược phẩm Vinh Gia được Cục An toàn thực phẩm (Bộ Y tế), cấp phép lưu hành sản phẩm vào ngày 29/6. Được biết, sản phẩm của Công ty Cổ phần Dược phẩm Vinh Gia là đơn vị cùng tham gia nghiên cứu loại thuốc nêu trên.
Tối 11/8, Công ty cổ phần Dược phẩm Vinh Gia có văn bản phản hồi về sự việc. Đơn vị này khẳng định "thực phẩm bảo vệ sức khỏe Vipdervir C là thực phẩm bảo vệ sức khỏe, không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh. Sản phẩm đã được công bố tại Cục An toàn thực phẩm với công dụng "hỗ trợ tăng cường sức đề kháng, hỗ trợ giảm nguy cơ mắc các bệnh do virus, do sức đề kháng kém gây ra". Do nhiều lý do khách quan, chủ quan, công ty chưa truyền thông quảng cáo cho sản phẩm này trên bất kỳ phương tiện truyền thông. Sản phẩm cũng chưa được bày bán tại các nhà thuốc.
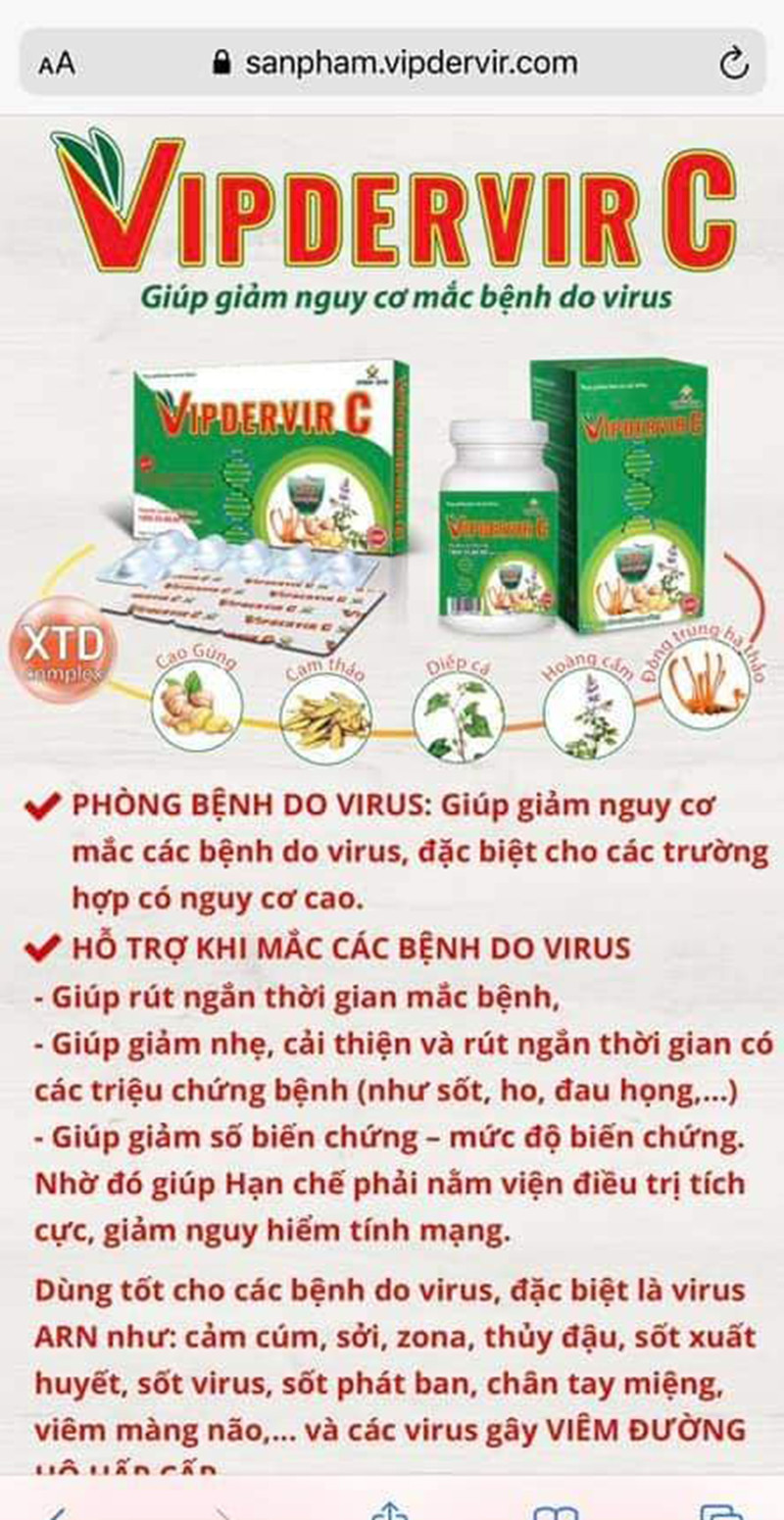
Mặc dù vậy, nhiều ý kiến cho rằng với tên gọi khá giống nhau, lại là sản phẩm phục vụ điều trị dịch bệnh Covid-19 có thể khiến người dân hiểu nhầm, đổ xô mua sản phẩm để sử dụng.
Vì vậy, với sản phẩm thực phẩm chức năng Vipdervir C của Công ty Cổ phần Dược phẩm Vinh Gia đã được cấp phép, người tiêu dùng cần phân biệt rõ và không bị lầm tưởng về công dụng, chức năng của sản phẩm này.
Tuy nhiên, không phải người tiêu dùng nào cũng đọc được thông tin về sự trùng hợp này trong khi bao bì nhãn mác, tên gọi của 2 sản phẩm là na ná như nhau. Bác sĩ Trần Văn Phúc - Bệnh viện Đa khoa Xanh Pôn nhận định: "Việc đặt tên 2 sản phẩm có công dụng hoàn toàn khác nhau với tên gọi "na ná" nhau có thể gây sự hiểu lầm cho người dùng rằng, 2 loại là 1, có khả năng chữa Covid-19 nên có thể người dân sẽ đổ xô đi mua. Nếu cố tình gây ra sự hiểu lầm ấy, câu chuyện không đơn giản là hiểu lầm nữa mà sẽ là trục lợi, lợi dụng các nhà khoa học để bán hàng”
Công bố tên thương mại của thuốc khi đang nghiên cứu?
Đây là câu hỏi nhiều nhà chuyên môn đặt ra đối với thuốc thử nghiệm Vipdervir do Viện Hàn lâm Khoa học và Công nghệ Việt Nam công bố. Bởi trên thực tế, Viện mới hoàn thiện giai đoạn thử nghiệm tiền lâm sàng thuốc Vipdervir để chuyển sang giai đoạn thử nghiệm lâm sàng trên người. Trong khi đó, theo Thông tư Quy định về thử thuốc trên lâm sàng, sản phẩm đang trong giai đoạn nghiên cứu mà chưa được chấp thuận lưu hành hay bán dưới dạng sản phẩm, được gọi là sản phẩm nghiên cứu hoặc thuốc nghiên cứu. Điều này sẽ giúp cho người đọc cũng như cộng đồng hiểu được bối cảnh mà sản phẩm này đang được nhắc, ví dụ trong các thử nghiệm lâm sàng.
Trong các nghiên cứu thử nghiệm tiền lâm sàng, các thuốc nghiên cứu thường được gọi tên dược chất hoặc tên/ký hiệu sản phẩm nghiên cứu. Việc này sẽ giúp cho các nhà chuyên môn có được thông tin rõ ràng, dễ tra cứu, kiểm chứng và so sánh với các nghiên cứu khác đang được triển khai.
Được biết, hiện nay, trên thế giới đã có nhiều nghiên cứu về các thuốc điều trị Covid-19, trong đó bao gồm cả Favipiravir, là dược chất của sản phẩm Vipdervir.
Theo các chuyên gia, việc công bố sản phẩm là nghiên cứu thành công thuốc trị Covid-19 khi mới tiến hành thử nghiệm tiền lâm sàng, đồng thời đưa luôn tên thương mại dễ gây hiểu lầm cho người dân và cộng đồng.
Dự kiến cuối năm thuốc điều trị Covid-19 được cấp phép
Tại cuộc họp báo trực tuyến ngày 10/8, đại diện Bộ Y tế cho biết với tiến trình nghiên cứu như hiện nay, hy vọng với thời gian nghiên cứu khoảng 2-3 tháng và cùng 1-2 tháng đánh giá tổng kết, cuối năm 2021 sản phẩm này có thể được cấp phép lưu hành. "Bộ Y tế sẽ phối hợp với đơn vị nghiên cứu, huy động mọi nguồn lực từ doanh nghiệp, nhà sản xuất, đón nhận nghiên cứu cơ bản để có đánh giá nhanh nhất, khoa học nhất, có sản phẩm phục vụ người dân"- đại diện Bộ Y tế nói.
Trước đó trong cuộc họp ngày 7/8, Hội đồng Đạo đức trong nghiên cứu Y sinh học Quốc gia, Bộ Y tế, đã đánh giá cao kết quả nghiên cứu tiền lâm sàng và chấp thuận đề cương nghiên cứu lâm sàng trên người bệnh nhiễm virus SARS-CoV-2. Do đó sản phẩm này được cho phép triển khai ngay giai đoạn 2, 3 trên đối tượng đích là bệnh nhân. Kết thúc giai đoạn 2, sau khi đánh giá an toàn, khả năng giảm tải lượng virus của các liều và chọn liều tối ưu, Hội đồng Đạo đức Quốc gia cho phép chuyển sang giai đoạn 3 với khoảng 200 người để đánh giá so sánh giữa 2 nhóm.
