Một công nghệ cứu cả thế giới
Công nghệ mRNA - vừa được vinh danh tại giải Nobel 2023 - đã được chứng minh trong thực tế khi đại dịch Covid-19 bùng phát, giúp các nhà khoa học nhanh chóng cung cấp các loại vaccine hiệu quả, đưa thế giới vượt qua đại địch an toàn.
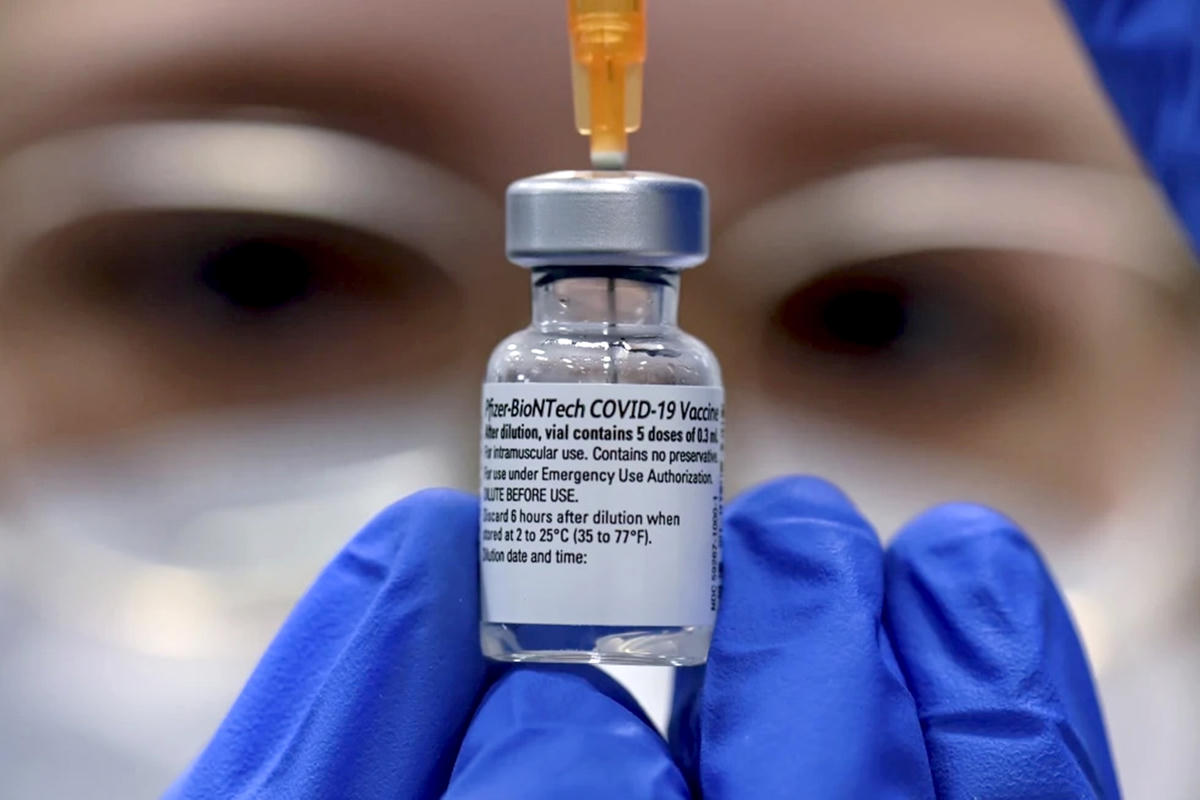
Đầu tuần này, Hội đồng Nobel tại Viện Karolinska ở thủ đô Stockholm của Thụy Điển đã công bố giải Nobel Y Sinh năm 2023 thuộc về hai nhà khoa học Katalin Kariko (nữ giáo sư chuyên ngành hóa sinh - sinh học phân tử người Hungary) và Drew Weissman (nhà khoa học người Mỹ) với công trình nghiên cứu về công nghệ mRNA trong sản xuất vaccine ngừa Covid-19.
Phát hiện đột phá của hai nhà khoa học đã thay đổi căn bản hiểu biết về cách mRNA tương tác với hệ thống miễn dịch của con người. Hai nhà khoa học cũng đã đóng góp vào nỗ lực phát triển vaccine với tốc độ chưa từng có trong thời điểm xảy ra đại dịch Covid-19 - một trong những mối đe dọa lớn nhất đối với sức khỏe con người trong thời hiện đại.
Đón đầu công nghệ
Làm thế nào các nhà khoa học có thể tạo ra vaccine Covid-19 với tốc độ nhanh như vậy? Một khởi đầu thuận lợi đã giúp ích, hơn 10 năm nghiên cứu hậu trường giúp công nghệ vaccine mới sẵn sàng đối mặt với thách thức ngay khi virus Corona bùng phát.
Tiến sĩ Anthony Fauci - chuyên gia về bệnh truyền nhiễm hàng đầu của Mỹ, cho rằng: “Tốc độ này phản ánh nhiều năm làm việc trước đó. Đó là điều mà công chúng phải hiểu”.
Việc tạo ra vaccine và có kết quả từ các nghiên cứu nghiêm ngặt chưa đầy một năm sau khi thế giới phát hiện ra một căn bệnh chưa từng thấy trước đây là điều khó tin, rút ngắn nhiều năm phát triển bình thường. Hai loại vaccine dẫn đầu của Mỹ được sản xuất theo cách hứa hẹn sự phát triển nhanh hơn có thể trở thành tiêu chuẩn - đặc biệt nếu chúng chứng tỏ được hiệu quả lâu dài.
“Cảm giác choáng váng tột độ” là cách mà Tiến sĩ C. Buddy Creec - chuyên gia về vaccine của Đại học Vanderbilt - mô tả phản ứng của các nhà khoa học khi các nghiên cứu riêng biệt cho thấy hai ứng cử viên vaccine có hiệu quả khoảng 95%. “Tôi nghĩ chúng ta đang bước vào thời kỳ hoàng kim của vaccine nhờ có công nghệ mRNA” - Tiến sĩ Creech cho biết trong cuộc họp báo của Hiệp hội Bệnh truyền nhiễm Mỹ.
Cả hai mũi tiêm – một mũi do Pfizer và BioNTech sản xuất, mũi còn lại do Moderna và Viện Y tế Quốc gia thực hiện – đều được gọi là RNA thông tin, hay mRNA vaccine.
Nhưng rất lâu trước khi Covid-19 xuất hiện, nền tảng phần lớn được đặt ra bởi hai luồng nghiên cứu khác nhau, một tại Viện nghiên cứu NIH và một tại Đại học Pennsylvania, bởi vì các nhà khoa học đã tìm hiểu một chút về các loại virus Corona khác từ trước đó khi dịch SARS và MERS bùng phát.
Tiến sĩ Tal Zaks - Giám đốc y tế của Moderna cho biết: “Khi đại dịch bắt đầu, chúng tôi đã có nền tảng vững chắc cả về mặt khoa học và kinh nghiệm xử lý mRNA”.
Phát hiện đột phá
Đồng chủ nhân giải Nobel Y Sinh 2023 - Tiến sĩ Drew Weissman cho biết, theo truyền thống, việc tạo ra vaccine đòi hỏi phải phát triển virus hoặc các mảnh virus và sau đó tinh chế chúng trước các bước tiếp theo trong pha chế vaccine. Nhưng cách tiếp cận của công nghệ mRNA hoàn toàn khác. Nó bắt đầu bằng một đoạn mã di truyền mang hướng dẫn tạo ra protein. Chọn đúng loại protein virus để nhắm mục tiêu và cơ thể sẽ biến thành một “nhà máy” sản xuất vaccine mini.
“Thay vì nuôi cấy virus trong thùng 50.000 lít và vô hiệu hóa nó, chúng tôi có thể cung cấp RNA và cơ thể chúng ta tạo ra protein để bắt đầu phản ứng miễn dịch” - Tiến sĩ Drew Weissman nói.
15 năm trước, phòng thí nghiệm của Tiến sĩ Weissman đã cố gắng khai thác mRNA để tạo ra nhiều loại thuốc và vaccine. Nhưng các nhà nghiên cứu phát hiện ra rằng, việc tiêm mã di truyền vào động vật cũng có thể gây ra tình trạng viêm nhiễm có hại. Vì vậy Tiến sĩ Weissman và một đồng nghiệp tại BioNTech, đồng thời là đồng chủ nhân giải Nobel Y Sinh 2023 – Giáo sư Katalin Kariko - đã tìm ra một sửa đổi nhỏ đối với khối RNA được phát triển trong phòng thí nghiệm, cho phép nó trượt qua các trọng điểm gây viêm mà không bị phát hiện.
Giám đốc khoa học của Pfizer - Tiến sĩ Philip Dormitzer cho biết: “Về cơ bản, họ có thể tạo ra một RNA tàng hình”. Sau đó, các nhà nghiên cứu khác đã bổ sung một lớp phủ chất béo, gọi là hạt nano lipid, giúp RNA tàng hình dễ dàng xâm nhập vào bên trong tế bào và bắt đầu sản xuất protein mục tiêu.
Trong khi đó tại NIH, nhóm của Tiến sĩ Barney Graham đã tìm ra mục tiêu phù hợp, bởi thiết kế phù hợp là rất quan trọng. Hóa ra các protein bề mặt cho phép nhiều loại virus bám vào tế bào người là những chất thay đổi hình dạng - sắp xếp lại hình dạng của chúng trước và sau khi chúng hợp nhất vào đúng vị trí. Pha vaccine sử dụng sai hình dạng sẽ không ngăn chặn được sự lây nhiễm.
Đó là một khám phá vào năm 2013, khi Tiến sĩ Graham - Phó Giám đốc Trung tâm nghiên cứu vaccine của NIH và đồng nghiệp Jason McLellan đang nghiên cứu một loại vacicne chống lại RSV, một bệnh hô hấp ở trẻ em đã thất bại hàng chục năm.
Họ đã nghiên cứu cấu trúc phù hợp của protein RSV và tìm hiểu các chỉnh sửa di truyền giúp ổn định protein ở hình dạng chính xác để phát triển vaccine. Họ tiếp tục áp dụng bài học đó cho các loại virus khác, bao gồm cả việc nghiên cứu vaccine cho MERS, một người anh em họ với Covid-19, mặc dù nó chưa tiến xa khi đại dịch bắt đầu.
Tiến sĩ Graham cho biết vào tháng 2 trước khi vacicne của NIH được thử nghiệm lần đầu tiên trên người: “Đó là điều giúp chúng tôi có thể thực hiện việc này một cách nhanh chóng. Một khi bạn có được chi tiết ở cấp độ nguyên tử, bạn có thể thiết kế protein để nó ổn định”.
Tương tự như vậy, BioNTech của Đức vào năm 2018 đã hợp tác với Pfizer để phát triển vacicne cúm dựa trên mRNA hiện đại hơn, cung cấp cho cả hai công ty một số kiến thức ban đầu về cách xử lý công nghệ. “Tất cả đều đã được chuẩn bị từ trước. Điều này không phải tự nhiên mà có” – Tiến sĩ Dormitzer của Pfizer khẳng định.
Giáo sư Kariko bắt đầu làm việc tại Philadelphia, tại Đại học Pennsylvania (UPenn) vào năm 1989, tập trung nghiên cứu ứng dụng điều trị của mRNA. Năm 1997, bà có một cuộc gặp gỡ tình cờ với Tiến sĩ Drew Weissman của Trường Y khoa Perelman thuộc Đại học Pennsylvannia. Cuộc gặp gỡ đã gieo hy vọng mới để bà Kariko tiếp tục nỗ lực. Khi bà Karikó nói với ông Weissman về công trình tạo mRNA của bà, ông Weissman đã nhận ra tiềm năng độc đáo trong hợp tác khoa học giữa họ. Từ đó, các tương tác và trao đổi khoa học đã phát triển với hiệu quả tối ưu nhất.